Magyar Kémikusok Lapja
ÉLETÜNK A VÍZ
Elméleti módszerek a víz fizikai kémiájában
Baranyai András
A mindennapi életben a víz az a kémiai anyag, amellyel a leggyakrabban találkozunk. Ezért nem is gondolunk arra, hogy mennyi különleges tulajdonsága van ennek az egyszerű molekulának, illetve a belőle felépülő gáz-, folyékony vagy szilárd halmazállapotú fázisoknak és oldatainak.
A víznek 15 kristályos és három amorf módosulata ismert szilárd fázisban. A módosulatok sokfélesége abból fakad, hogy a hétköznapi, hexagonális jég sűrűsége (0,917 g/cm3) kicsi. Összenyomva a szerkezet továbbra is szeretné megtartani a hidrogénkötéseket, mert azok biztosítják a kristály összetartó erejét. Ezért a nyomás alatt keletkező polimorf módosulatok változatos rácsokba rendeződnek, hogy a négy hidrogénkötést előállítsák A másik tényező, ami a módosulatok számát növeli, hogy majdnem minden módosulatnak létezik egy proton-rendezett és proton-rendezetlen verziója. A rendezettség azt jelenti, hogy egy adott kristálytani pozícióban a hidrogénkötések ugyanabba az irányba mutatnak. A rendezetlen hexagonális jégnek is van egy rendezett párja.
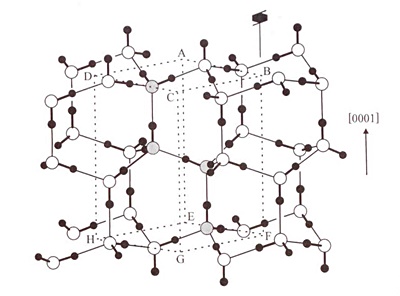
A hétköznapi, hexagonális jég térszerkezete. A szürkével jelölt oxigének határozzák meg az elemi cella négy molekuláját
A jég kristályos módosulatainak sokfélesége is jól mutatja a víz rendkívül változatos viselkedését. Ez a rendkívüliség azonban a víz szinte minden tulajdonságában jelen van. Ha egy „rendesen” viselkedő analóggal, a metánnal vetjük össze, akkor több mint hatvan tulajdonságáról mondhatjuk el, hogy anomális. A „normális” viselkedésű anyagokban ugyanis a tulajdonságok a hőmérséklet vagy a nyomás függvényében monoton csökkennek vagy nőnek, szemben a víz számos szélsőértéket (maximumot vagy minimumot) mutató viselkedésével. Közismert a két legszembetűnőbb sűrűséganomália: a víz 4 °C-on a legsűrűbb és a fagyáskor keletkező kristályos fázis, a hexagonális jég sűrűsége jóval kisebb, mint a vízé. (Ezért tud kitelelni a tavak élővilága.)