Magyar Kémikusok Lapja
Analitikai kémia – 2018
A biologikum analitika kihívásai
Urbányi Zoltán
A fehérjemolekulákat hatóanyagként tartalmazó gyógyszerek (biologikumok) elterjedése és felfutása az 1990-es években kezdődött és napjainkban is tart. 2014-os adatok szerint a világ 10 legnagyobb árbevételű gyógyszere közül 7 biologikum volt. Az ilyen gyógyszerek sikerét elsősorban a kismolekulákénál nagyobb specificitásuk és hatékonyságuk indokolja. Ezek a gyógyszermolekulák nagy affinitással és nagy szelektivitással képesek felismerni a célmolekulát, ami lehet sejtfelszíni vagy szolubilis antigén, receptor, vagy akár a receptor ligandja. A hatóanyagok nagy hatékonysága és mérete, szerkezetének komplexitása természetesen nem függetlenek egymástól.
Első megközelítésben a fehérjék és az egyéb szerves molekulák kémiailag nem sokban különböznek. Egyaránt szén, hidrogén, nitrogén, kén, esetleg foszfor vagy fémionok építik fel, a molekulákban lévő kötéstípusok is megegyeznek a szerves kémiában ismert kötéstípusokkal. Mi tehát a különbség?
Ha közelebbről megnézzük ezeket a molekulákat, látjuk, hogy míg a Vinpocetin huszonkét szénatomot tartalmaz, addig egy közepes méretű terápiás fehérje, a Filgrastim nyolcszáznegyvenötötöt, a klinikumban szintén elterjedt monoklonális antitestek pedig több mint háromezer-négyszázat. A nagy méret azonban nagyobb komplexitással, nagyobb változékonysággal is társul. Ennek forrása egyrészt a fehérjék térszerkezetének nagy variabilitása a másod-, harmad- és negyedrendű szerkezeti szinteken, másrészt a poszttranszlációs módosítások és egyéb olyan módosulatok keletkezése, amelyek akár a gyártás közben, akár a fehérje tárolása során is keletkezhetnek.
A poszttranszlációs módosulatok gyakori fajtája a glikoziláció. Az eritropoetin esetében több mint harmincféle glikozilációs változatot írtak le, melyek akár egyetlen kiszerelési egységben együttesen is jelen lehetnek. A feldolgozás, illetve tárolás során különböző oxidált, deamidált és egyéb kémiailag módosított variánsok keletkeznek, ami tovább növeli a gyógyszermolekula összetettségét. Steven Kozlowskinak, az FDA munkatársának becslése szerint monoklonális antitestek esetében a különböző variánsokból együttesen mintegy 6·108 féle lehet jelen akár egyetlen ampullában. Ezek a számok jól mutatják a biologikum-analitika előtt álló kihívásokat, a feladat bonyolultságát.
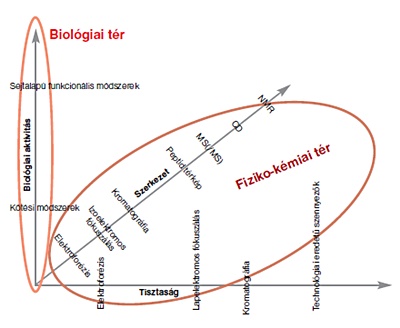
A biológiai tér és a fizikai kémiai tér
Jogosan vetődik fel a kérdés: ilyen fokú komplexitás mellett hogyan lehet esély arra, hogy ezeket a fehérjéket a gyógyszerek esetében elvárt alapossággal, részletességgel és pontossággal vizsgáljuk? Ezt csak akkor tudjuk megtenni, ha az ortogonális módszerek arzenálját vetjük be és a kapott adatokat komplexen értékeljük, hiszen minden egyes vizsgálat a fehérje jellemzőinek egy kis részéről ad információt. Méretükből és komplexitásukból adódóan még a modern spektroszkópiai és diffrakciós módszerek sem képesek arra, hogy pontos képet adjanak a molekula háromdimenziós szerkezetéről, ezért a szerkezeti és biológiaiaktivitás-adatokat együttesen kell értékelnünk. A biológiai aktivitásban tapasztalt eltérések utalhatnak olyan szerkezeti különbözőségekre, amelyeket fizikokémiai módszerekkel nem tudunk detektálni. Az ábrán bemutatott 3 dimenziós grafikon ezt hivatott szemléltetni.




